Ethanol
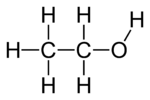
Ethanol, auch bekannt als Ethylalkohol, Alkohol oder Getreidealkohol, ist eine brennbare, farblose, leicht toxische chemische Verbindung mit einem unverwechselbaren parfümartigen Geruch. Ethanol ist der Grundbestandteil alkoholischer Getränke. Im allgemeinen Gebrauch wird es oft einfach als Alkohol bezeichnet. Seine molekulare Formel wird verschieden als EtOH, CH3CH2OH, C2H5OH oder C2H6O dargestellt.
Inhalt
Herstellung
Ethanol wird sowohl in der Petrochemie, durch die Hydratation von Ethylen und biologisch durch Fermentation von Zucker mit Hefe hergestellt.
Ethylen-Hydratation
Ethanol zur Verwendung als industrielles Einsatzmaterial wird am häufigsten aus petrochemischen Einsatzmaterialien hergestellt, typischerweise durch die säurekatalysierte Hydratation von Ethen, dargestellt durch die chemische Gleichung:
C2H4 + H2O → CH3CH2OH
Der Katalysator ist in der Regel Phosphorsäure, absorbiert auf einem porösen Träger wie Diatomeenerde oder Holzkohle; Dieser Katalysator wurde erstmals für die großtechnische Ethanolproduktion von der Shell Oil Company im Jahre 1947 eingesetzt. Feste Katalysatoren, meist verschiedene Metalloxide, wurden auch in der chemischen Literatur erwähnt.
In einem älteren Prozess, der zuerst im industriellen Maßstab im Jahre 1930 von Union Carbide praktiziert wurde, aber mittlerweile nicht mehr verwendet wird, wurde Ethen indirekt hydratisiert, indem man es mit konzentrierter Schwefelsäure zur Herstellung von Ethylsulfat umsetzte, das dann zu Ethanol hydrolysiert wurde. Regenerieren die Schwefelsäure:
C2H4 + H2SO4 → CH3CH2SO4H
CH3CH2SO4H + H2O → CH3CH2OH + H2SO4
Fermentation
Ethanol zur Verwendung in alkoholischen Getränken und die überwiegende Mehrheit von Ethanol zur Verwendung als Brennstoff wird durch Fermentation hergestellt: Wenn bestimmte Arten von Hefe (vor allem Saccharomyces cerevisiae) den Zucker in Abwesenheit von Sauerstoff metabolisieren, produzieren sie Ethanol und Kohlendioxid. Die gesamte chemische Reaktion, die durch die Hefe durchgeführt wird, kann durch die chemische Gleichung dargestellt werden:
C6H12O6 → 2 CH3CH2OH + 2 CO2
Der Prozess der Kultivierung von Hefe unter Bedingungen zur Herstellung von Alkohol wird als Brauen bezeichnet. Brauen kann nur relativ verdünnte Konzentrationen von Ethanol in Wasser produzieren; Konzentrierte Ethanollösungen sind gegenüber Hefe toxisch. Die meisten Ethanol-toleranten Stämme von Hefe können in bis zu etwa 15 Prozent Ethanol (Volumen) überleben.
Während des Fermentationsverfahrens ist es wichtig, dass Sauerstoff nicht zum Ethanol gelangt, da sonst das Ethanol zu Essigsäure (Essig) oxidiert würde. Auch in Gegenwart von Sauerstoff würde die Hefe einer aeroben Atmung unterzogen, um nur Kohlendioxid und Wasser zu erzeugen.
 | |
Allgemeines | |
| Name | Ethanol |
| Andere Namen |
|
| Summenformel | C2H6O |
| CAS-Nummer | 64-17-5 |
| Kurzbeschreibung | klare, farblose, würzig riechende und brennend schmeckende, leichtentzündliche, hygroskopische Flüssigkeit |
Eigenschaften | |
| Molare Masse | 46,07 g·mol−1 |
| Aggregatzustand | flüssig |
| Dichte | 0,7893 g·cm−3 (20 °C) |
| Schmelzpunkt | −114,5 °C |
| Siedepunkt | 78,32 °C |
| Dampfdruck | 58 hPa (20 °C) |
| Löslichkeit | beliebig mit Wasser, Diethylether, Chloroform, Benzin und Benzol mischbar |
Eigenschaften
Ethanols Hydroxylgruppe kann an der Wasserstoffbindung teilnehmen. Auf molekularer Ebene besteht flüssiges Ethanol aus wasserstoffgebundenen Paaren von Ethanolmolekülen; Dieses Phänomen macht Ethanol viskoser und weniger flüchtig als weniger polare organische Verbindungen mit ähnlichem Molekulargewicht. In der Dampfphase gibt es wenig Wasserstoffbindung; Ethanoldampf besteht aus einzelnen Ethanolmolekülen. Ethanol, wie die meisten kurzkettigen Alkohole, ist entflammbar, farblos, hat einen starken Geruch und ist flüchtig.
Ethanol hat einen Brechungsindex von 1.3614. Ethanol ist ein vielseitiges Lösungsmittel. Es ist mit Wasser und mit den meisten organischen Flüssigkeiten mischbar, einschließlich unpolarer Flüssigkeiten wie aliphatischen Kohlenwasserstoffen. Organische Feststoffe mit niedrigem Molekulargewicht sind üblicherweise in Ethanol löslich. Unter den ionischen Verbindungen sind viele monovalente Salze in Ethanol wenigstens etwas löslich, wobei Salze von großen, polarisierbaren Ionen löslicher sind als Salze kleinerer Ionen. Die meisten Salze von mehrwertigen Ionen sind in Ethanol praktisch unlöslich.
Verwendung
Die größte Einzelbenutzung von Ethanol ist als Motorbrennstoff und Kraftstoffzusatzstoff. Die größte nationale Brennstoff-Ethanol-Industrie gibt es in Brasilien (in Brasilien verkauftes Benzin enthält mindestens 20 Prozent Ethanol und wasserhaltiges Ethanol wird auch als Brennstoff verwendet)
Ethanol wurde als Brennstoff in bipropellanten Raketenfahrzeugen in Verbindung mit einem Oxidationsmittel verwendet. Zum Beispiel hat die deutsche V-2-Rakete des Zweiten Weltkrieges Ethanol-Treibstoff verwendet.
Alkoholische Getränke variieren erheblich in ihrem Ethanolgehalt. Der Ethanolgehalt eines Getränks wird üblicherweise in Form des Volumenanteils von Ethanol im Getränk gemessen, ausgedrückt entweder als Prozentsatz oder in alkoholhaltigen Einheiten.
Ethanol wird in medizinischen Wischtüchern und in den meisten üblichen antibakteriellen Handdesinfizientengelen in einer Konzentration von etwa 62 Prozent (Gewichtsprozent, nicht Volumen) als Antiseptikum verwendet.
Ethanol kaufen
In Deutschland ist Alkohol frei verkäuflich und bedarf lediglich auf Seiten des Verkäufers einer gesonderten Lizens, insbesondere bei Gaststättenbetreibern ist eine Schank-Lizenz notwendig.
Sicherheitshinweise und Risiken
Das Ausgangsprodukt des Ethanol-Metabolismus, Acetaldehyd, ist toxischer als Ethanol selbst.
Viele gesundheitliche Schädigungen entstehen mit chronischen Ethanol-Missbrauch, einschließlich Leberzirrhose, Alkoholismus und einige Formen von Krebs konnten mit Acetaldehyd verknüpft.
